岐阜大学 関東化学と核酸医療研究用試薬の製造販売契約締結核酸医薬(RNA)の長寿命化、抗がん活性を付与する 5種の試薬が実用化
国立大学法人 岐阜大学は、工学部化学・生命工学科 北出幸夫特任教授らがこれまでに開発した、5種の化合物(後述)について、国内トップクラスの試薬メーカーである関東化学に試薬として製造販売を許諾する契約を2016年4月に締結しました。この5種の化合物は、核酸医薬として期待されているRNAの末端に結合させることで、RNAの分解耐性を向上させたり、抗がん活性の増強、RNAのPETラベル化や、目的の病巣まで送達させる手助けをしたりするものです。今後、関東化学はこれらの化合物を試薬として国内外の研究者や製薬企業向けに製造販売する予定です。これらの試薬の普及により、核酸医療の研究開発が効率化することが期待されます。
国立大学法人 岐阜大学は、工学部化学・生命工学科 北出幸夫特任教授らがこれまでに開発した、5種の化合物(後述)について、国内トップクラスの試薬メーカーである関東化学に試薬として製造販売を許諾する契約を2016年4月に締結しました。この5種の化合物は、核酸医薬として期待されているRNAの末端に結合させることで、RNAの分解耐性を向上させたり、抗がん活性の増強、RNAのPETラベル化や、目的の病巣まで送達させる手助けをしたりするものです。
今後、関東化学はこれらの化合物を試薬として国内外の研究者や製薬企業向けに製造販売する予定です。これらの試薬の普及により、核酸医療の研究開発が効率化することが期待されます。
(「核酸医療」については、下記【核酸医療とは】をご参照ください)
●今回実用化される北出幸夫特任教授らの研究開発の成果
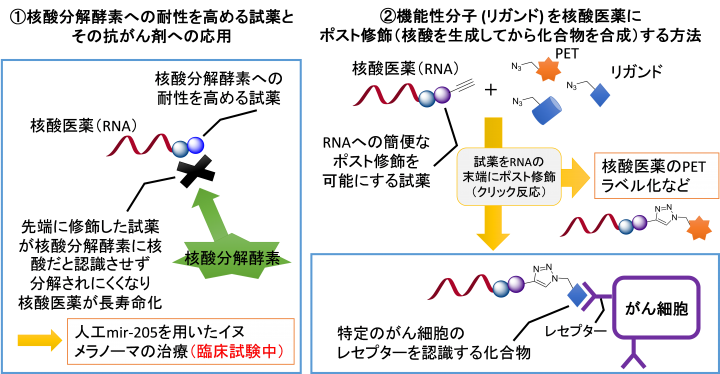
北出特任教授らはこれまでに、各種RNAの末端に修飾することで、①核酸分解酵素への耐性を高める化合物及び②機能性分子 (リガンド)を核酸医薬の末端にポスト修飾(核酸を生成してから化合物を合成)する試薬を研究開発してきました。今回これらの機能を付与する化合物が試薬として初めて実用化されます。
①核酸分解酵素への耐性を高める試薬とその抗がん剤への応用
RNAやDNAは体内の核酸分解酵素(ヌクレアーゼ)によって分解されやすいという問題があります。核酸医薬としてRNAを利用するために、分解酵素へのRNAの耐性を高めるために、RNA全体を修飾する方法が行われてきました。ところが、この方法においては、RNAが必要以上に安定なため健康な細胞に悪影響をおよぼす懸念もありました。
北出特任教授らは、核酸の末端に修飾することで核酸医薬の分解酵素耐性を高める試薬1~3の3種を研究開発しました。核酸分解酵素は核酸の主に末端を認識して分解します。これらの化合物で修飾したRNAは、分解酵素によって認識されにくくなり、分解されずに長寿命化し、長時間効果を継続することができます。(参考論文1)
これらの化合物による核酸医薬の修飾は、医薬品合成分野の研究者が比較的容易に行うことができます。関東化学はこれらの化合物を試薬として製造し、国内外の研究者や製薬企業に販売する予定です。
各種がん細胞の表面には、それぞれ特定の物質を受容するレセプター(受容体)があります。北出特任教授らと大学院連合創薬医療情報研究科の赤尾幸博教授らは、上記試薬で化学修飾した各種miRNAにメラノーマ、大腸がん、膀胱がんなどに対する抗がん活性を確認しています。
現在、岐阜大学では化学修飾miRNAの1種を用いて、北出特任教授と赤尾教授がヒトメラノーマ細胞に対する抗がん活性を確認し、岐阜大学附属動物病院の森崇教授がイヌのメラノーマ治療の臨床試験を行っています。 (参考論文2)
北出特任教授らは大学の医学系研究室や製薬企業などの研究機関から依頼があれば、医薬品候補のライブラリーの提供、化学修飾法などの技術提供や共同研究を行うことを想定しています。
②機能性分子 (リガンド) を核酸医薬にポスト修飾(核酸を生成してから化合物を合成)する方法
機能性分子 (リガンド)を核酸の末端に修飾する従来の方法としては、先に末端に位置する化合物を合成してから、目的とする核酸を逐次重合、伸長させ目的とするRNA分子を得る方法もあります。ところが、核酸を逐次重合、伸長させRNA分子を得るのは、合成手順が複雑で、時間もかかるという問題があります。
北出特任教授らが開発したポスト修飾法では、先に目的のRNA分子を合成して、後で機能性分子 (リガンド)をRNAの末端に結合させます。核酸医薬の末端への機能性分子 (リガンド)の結合は比較的容易であるため、核酸医薬の研究開発を効率的に行うことができます。
機能性分子 (リガンド)のRNAへの修飾は、試薬4または5を用いて合成したアセチレン残基を有するRNA分子と、リガンド側のアジド基(N3)によるクリック反応(注9)により結合させます。通常はクリック反応の際にRNAも分解されますが、北出特任教授らは、RNAを分解しない条件でクリック反応を実施する方法を開発しました(参考論文3)。
●社会への影響:核酸医療の研究開発を効率化
通常、核酸医薬に必要な試薬を1種類合成するには2?3週間程度かかります。関東化学がこれらの試薬を製造販売することにより、研究者は容易に様々な試薬を試せるようになります。これらの試薬の普及により、核酸医療の研究開発の効率化が期待されます。
【核酸医療とは】2006年にRNA干渉(注1)を発見した米国の生物学者がノーベル医学生理学賞を受賞したことにより、核酸医療が次世代の医療として注目されるようになりました。核酸医療はがんやウイルス性疾患などの重篤な疾患の治療法としても期待されています。核酸医療には、特定の塩基配列(注2)や特定のタンパク質を認識するように化学合成した核酸(DNA(注3)やRNA(注4))を核酸医薬(注5)として用います。核酸医薬がDNAの転写(注6)やmRNA(注7)による翻訳(注8)を阻害したり、特定のタンパク質の機能を阻害したりすることで、好ましくない遺伝子の機能を阻害し、疾患を治療します。
注1 RNA干渉:siRNA(short interfering RNA)と呼ばれる21~23 merの二本鎖RNAによって配列特異的にmRNAが分解され、タンパク質への翻訳が阻害される現象。
注2 塩基配列:DNA、RNAなどの核酸を構成するヌクレオチドの結合順。
注3 DNA(Deoxyribo-nucleic Acid):デオキシリボ核酸。細胞核に主に存在する二重らせん構造の物質。らせんの内側の塩基配列によって遺伝情報を記録している。
注4 RNA (ribonucleic acid):リボ核酸。核酸の一種。タンパク質の設計図。
注5 核酸医薬:核酸医療に用いる医薬品。DNAやRNAの塩基配列を認識し、標的となるRNAと結合し、好ましくない遺伝子の働きを阻害することにより治療を行います。
注6 転写:DNAの塩基配列を読み取りmRNAを合成すること。
注7 mRNA(messenger RNA):DNAの塩基配列を細胞核内で転写する一本鎖RNA。mRNAは転写後にリボソームに移動して、そこで塩基配列を元にタンパク質が合成される。
注8 翻訳:mRNAの塩基配列を読み取り、アミノ酸を結合し、タンパク質を合成すること。
注9 クリック反応:比較的シンプルな構造の化合物同士を、炭素-ヘテロ原子結合反応により新たな機能性分子を合成する方法。周辺の環境にほとんど影響を受けない。
●北出 幸夫(KITADE YUKIO)プロフィール
岐阜大学 工学部化学・生命工学科 特任教授
愛知工業大学 教授
薬学博士
<略歴>
1978年 岐阜薬科大学製造薬学科卒業
1980年 岐阜薬科大学大学院薬学研究科修士課程修了
1984年 薬学博士(岐阜薬科大学)
1985年~1987年 米国国立衛生研究所(N.I.H)博士研究員
1994年 岐阜大学 工学部助教授、2000年 文部省在外研究員(米国北アリゾナ大学化学科)
2001年 岐阜大学 工学部教授、(以下「岐阜大学」略) 2002年 工学部生命工学科長
2004年 人獣感染防御研究センター兼務、2005年 先端創薬研究センター長併任
2007年 大学院連合創薬医療情報研究科長、2016年 工学部特任教授、2016年 愛知工業大学教授
【参考URL】
・参考論文
1.Kitamura, Y., Masegi, Y., Ogawa, S., Nakashima, R., Akao, Y., Ueno, Y., Kitade, Y., Chemically modified siRNAs and miRNAs bearing urea/thiourea-bridged aromatic compounds at their 3'-end for RNAi therapy, Bioorg. Med. Chem., 21, 4494-4501 (2013).
2.Akao, Y., Nakagawa, Y., Hirata, I., Iio, A., Itoh, T., Kojima, K., Nakashima, R., Kitade, Y., and Naoe, T., Role of anti-oncomirs miR-143 and -145 in human colorectal Tumors, Cancer Gene Therapy, 17, 398-408 (2010).
Noguchi, S., Iwasaki, J., Kumazaki, M., Mori, T., Maruo, K., Sakai, H., Yamada, N., Shimada, K., Naoe, T., Kitade, Y. and Akao, Y.: Chemically Modified Synthetic microRNA-205 Inhibits the Growth of Melanoma Cells In Vitro and In Vivo. Mol Ther, 21: 1204-1211(2013).
3.Shiraishi, T., Kitamura, Y., Ueno, Y., Kitade, Y., Synthesis of oligonucleotides possessing versatile probes for PET labelling and their rapid ligand-free click reaction, Chem. Commun., 47, 2691-2693 (2011).
・岐阜大学工学部化学・生命工学科
http://www.eng.gifu-u.ac.jp/kagaku-seimei/
●関東化学との製造販売契約の対象となる試薬
・核酸分解酵素への耐性を高める試薬
DMT-Benzenediol-CE Phosphoramidite
DMT-Benzenediol-CPG
DMT-Pyridinediol-CPG
・試薬を核酸医薬にポスト修飾するための試薬
DMT-Ethynylbenzenediol-CE Phosphoramidite
DMT-Ethynylbenzenediol-CPG
添付画像・資料
添付画像をまとめてダウンロード
企業情報
| 企業名 | 国立大学法人東海国立大学機構 岐阜大学 |
|---|---|
| 代表者名 | 森脇 久隆 |
| 業種 | 国・自治体・公共機関 |
コラム
国立大学法人東海国立大学機構 岐阜大学の
関連プレスリリース
-
ゼノバイオティック、化合物のデータ約14000件の機械学習により化合物の毒性予測ソフトウェアの予測精度を95%に向上
2021年3月11日 14時
-
男性に下痢、女性に便秘が多い原因・神経伝達物質の性差を発見、岐阜大学 志水泰武教授 "The Journal of Physiology"に論文掲載
2020年12月25日 11時
-
物理ゲルの性能を付与した次世代コンクリートを開発、岐阜大学工学部 木村浩准教授と株式会社安部日鋼工業が特許申請
2020年2月27日 10時
-
世界で初めて、50年間にわたり課題とされてきた化学反応に成功、シアル酸の立体選択的結合反応(α結合のみの合成)を実現、科学論文誌「Science」に掲載
2019年5月17日 10時
国立大学法人東海国立大学機構 岐阜大学の
関連プレスリリースをもっと見る
















